
手機掃描下載
應用指數:4 分
類型:新聞性質:軟件版本:v1.1.1.25大小:26.6 MB更新:2024-06-09語言:中文等級:平臺:Android官網:https://benhuisen.com廠商:北京本匯森科技有限公司
應用介紹應用截圖相關版本網友評論下載地址
化學方程式app2024最新版為您提供化學方程式的俗名、顏色、物質以及周期表的查詢,通過app一鍵完成初高中化學方程式的學習,是您學習化學的手機必備app!
“化學方程式”軟件包含方程式、俗稱、顏色、性質與周期表五大模塊。每一模塊緊密結合、相輔相成,可以很好的幫助同學們更全面學習與認知。

【軟件宗旨】
本軟件一直致力于“為同學們提供便捷、齊全的化學查詢工具”為宗旨,經過三年發展,數據也日趨完善,目前已經滿足了初高中大部分同學的需求。本軟件獨特的搜索技術以及顯示技術,可以幫助你迅速的找到你要查找的知識點,方便而快捷。
【作者寄語】
化學是一門很神奇的學科,我們生活中的方方面面都離不開化學,化學的魅力之處在于她能夠解釋清楚我們所處環境中的各種現象與本質。本軟件著眼點在課本,卻高于課本。軟件的精益求精也是我們一直奮斗的目標。希望本軟件能夠一直伴隨同學們的學生生涯,給同學們帶來學習上的便利。我與你們,共同探索、共同進步!
甲烷燃燒的化學方程式
有兩個。當甲烷完全燃燒時,其化學方程式為:CH4+2O2=CO2+2H2O;當甲烷不完全燃燒時,其化學方程式為:2CH4+3O2=2CO+4H2O。
一、氧氣的性質:
(1)單質與氧氣的反應:(化合反應)
1.鎂在空氣中燃燒:2Mg+O2點燃2MgO
2.鐵在氧氣中燃燒:3Fe+2O2點燃Fe3O4
3.銅在空氣中受熱:2Cu+O2加熱2CuO
4.鋁在空氣中燃燒:4Al+3O2點燃2Al2O3
5.氫氣中空氣中燃燒:2H2+O2點燃2H2O
6.紅磷在空氣中燃燒(研究空氣組成的實驗):4P+5O2點燃2P2O5
7.硫粉在空氣中燃燒:S+O2點燃SO2
8.碳在氧氣中充分燃燒:C+O2點燃CO2
9.碳在氧氣中不充分燃燒:2C+O2點燃2CO
(2)化合物與氧氣的反應:
10.一氧化碳在氧氣中燃燒:2CO+O2點燃2CO2
11.甲烷在空氣中燃燒:CH4+2O2點燃CO2+2H2O
12.酒精在空氣中燃燒:C2H5OH+3O2點燃2CO2+3H2O
(3)氧氣的來源:
13.玻義耳研究空氣的成分實驗2HgO加熱Hg+O2↑
14.加熱高錳酸鉀:2KMnO4加熱K2MnO4+MnO2+O2↑(實驗室制氧氣原理1)
15.過氧化氫在二氧化錳作催化劑條件下分解反應:H2O2MnO22H2O+O2↑(實驗室制氧氣原理2)
二、自然界中的水:
16.水在直流電的作用下分解(研究水的組成實驗):2H2O通電2H2↑+O2↑
17.生石灰溶于水:CaO+H2O==Ca(OH)2
18.二氧化碳可溶于水:H2O+CO2==H2CO3
三、質量守恒定律:
19.鎂在空氣中燃燒:2Mg+O2點燃2MgO
20.鐵和硫酸銅溶液反應:Fe+CuSO4===FeSO4+Cu
21.氫氣還原氧化銅:H2+CuO加熱Cu+H2O
22.鎂還原氧化銅:Mg+CuO加熱Cu+MgO
四、碳和碳的氧化物:
(1)碳的化學性質
23.碳在氧氣中充分燃燒:C+O2點燃CO2
24.木炭還原氧化銅:C+2CuO高溫2Cu+CO2↑
25.焦炭還原氧化鐵:3C+2Fe2O3高溫4Fe+3CO2↑
(2)煤爐中發生的三個反應:(幾個化合反應)
26.煤爐的底層:C+O2點燃CO2
27.煤爐的中層:CO2+C高溫2CO
28.煤爐的上部藍色火焰的產生:2CO+O2點燃2CO2
(3)二氧化碳的制法與性質:
29.大理石與稀鹽酸反應(實驗室制二氧化碳):
CaCO3+2HCl==CaCl2+H2O+CO2↑
30.碳酸不穩定而分解:H2CO3==H2O+CO2↑
31.二氧化碳可溶于水:H2O+CO2==H2CO3
32.高溫煅燒石灰石(工業制二氧化碳):CaCO3高溫CaO+CO2↑
33.石灰水與二氧化碳反應(鑒別二氧化碳):
Ca(OH)2+CO2===CaCO3↓+H2O
(4)一氧化碳的性質:
34.一氧化碳還原氧化銅:CO+CuO加熱Cu+CO2
35.一氧化碳的可燃性:2CO+O2點燃2CO2
其它反應:
36.碳酸鈉與稀鹽酸反應(滅火器的原理):
Na2CO3+2HCl==2NaCl+H2O+CO2↑
五、燃料及其利用:
37.甲烷在空氣中燃燒:CH4+2O2點燃CO2+2H2O
38.酒精在空氣中燃燒:C2H5OH+3O2點燃2CO2+3H2O
39.氫氣中空氣中燃燒:2H2+O2點燃2H2O
六、金屬
(1)金屬與氧氣反應:
40.鎂在空氣中燃燒:2Mg+O2點燃2MgO
41.鐵在氧氣中燃燒:3Fe+2O2點燃Fe3O4
42.銅在空氣中受熱:2Cu+O2加熱2CuO
43.鋁在空氣中形成氧化膜:4Al+3O2=2Al2O3
(2)金屬單質+酸--------鹽+氫氣(置換反應)
44.鋅和稀硫酸Zn+H2SO4=ZnSO4+H2↑
45.鐵和稀硫酸Fe+H2SO4=FeSO4+H2↑
46.鎂和稀硫酸Mg+H2SO4=MgSO4+H2↑
47.鋁和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑
48.鋅和稀鹽酸Zn+2HCl==ZnCl2+H2↑
49.鐵和稀鹽酸Fe+2HCl==FeCl2+H2↑
50.鎂和稀鹽酸Mg+2HCl==MgCl2+H2↑
51.鋁和稀鹽酸2Al+6HCl==2AlCl3+3H2↑
(3)金屬單質+鹽(溶液)-------新金屬+新鹽
52.鐵和硫酸銅溶液反應:Fe+CuSO4==FeSO4+Cu
53.鋅和硫酸銅溶液反應:Zn+CuSO4==ZnSO4+Cu
54.銅和硝酸汞溶液反應:Cu+Hg(NO3)2==Cu(NO3)2+Hg
(3)金屬鐵的治煉原理:
55.3CO+2Fe2O3高溫4Fe+3CO2↑
七、酸、堿、鹽
1、酸的化學性質
(1)酸+金屬--------鹽+氫氣(見上)
(2)酸+金屬氧化物--------鹽+水
56.氧化鐵和稀鹽酸反應:Fe2O3+6HCl==2FeCl3+3H2O
57.氧化鐵和稀硫酸反應:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
58.氧化銅和稀鹽酸反應:CuO+2HCl==CuCl2+H2O
59.氧化銅和稀硫酸反應:CuO+H2SO4==CuSO4+H2O
(3)酸+堿--------鹽+水(中和反應)
60.鹽酸和燒堿起反應:HCl+NaOH==NaCl+H2O
61.鹽酸和氫氧化鈣反應:2HCl+Ca(OH)2==CaCl2+2H2O
62.氫氧化鋁藥物治療胃酸過多:3HCl+Al(OH)3==AlCl3+3H2O
63.硫酸和燒堿反應:H2SO4+2NaOH==Na2SO4+2H2O
(4)酸+鹽--------另一種酸+另一種鹽
64.大理石與稀鹽酸反應:CaCO3+2HCl==CaCl2+H2O+CO2↑
65.碳酸鈉與稀鹽酸反應:Na2CO3+2HCl==2NaCl+H2O+CO2↑
66.碳酸氫鈉與稀鹽酸反應:NaHCO3+HCl==NaCl+H2O+CO2↑
67.硫酸和氯化鋇溶液反應:H2SO4+BaCl2==BaSO4↓+2HCl
2、堿的化學性質
(1)堿+非金屬氧化物--------鹽+水
68.苛性鈉暴露在空氣中變質:2NaOH+CO2==Na2CO3+H2O
69.苛性鈉吸收二氧化硫氣體:2NaOH+SO2==Na2SO3+H2O
70.苛性鈉吸收三氧化硫氣體:2NaOH+SO3==Na2SO4+H2O
71.消石灰放在空氣中變質:Ca(OH)2+CO2==CaCO3↓+H2O
72.消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O
(2)堿+酸--------鹽+水(中和反應,方程式見上)
(3)堿+鹽--------另一種堿+另一種鹽
73.氫氧化鈣與碳酸鈉:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
3、鹽的化學性質
(1)鹽(溶液)+金屬單質-------另一種金屬+另一種鹽
74.鐵和硫酸銅溶液反應:Fe+CuSO4==FeSO4+Cu
(2)鹽+酸--------另一種酸+另一種鹽
75.碳酸鈉與稀鹽酸反應:Na2CO3+2HCl==2NaCl+H2O+CO2↑
碳酸氫鈉與稀鹽酸反應:NaHCO3+HCl==NaCl+H2O+CO2↑
(3)鹽+堿--------另一種堿+另一種鹽
76.氫氧化鈣與碳酸鈉:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(4)鹽+鹽-----兩種新鹽
77.氯化鈉溶液和硝酸銀溶液:NaCl+AgNO3==AgCl↓+NaNO3
78.硫酸鈉和氯化鋇:Na2SO4+BaCl2==BaSO4↓+2NaCl
v1.1.1.25 版本
1、支持倍速播放
2、優化數據同步
3、修復軟件崩潰
應用截圖
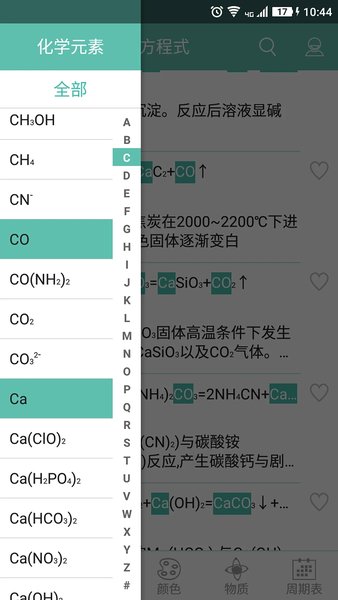
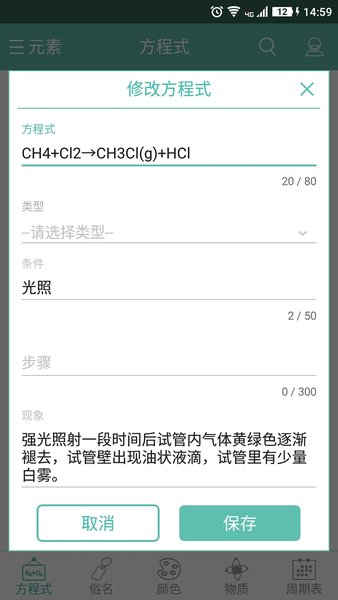
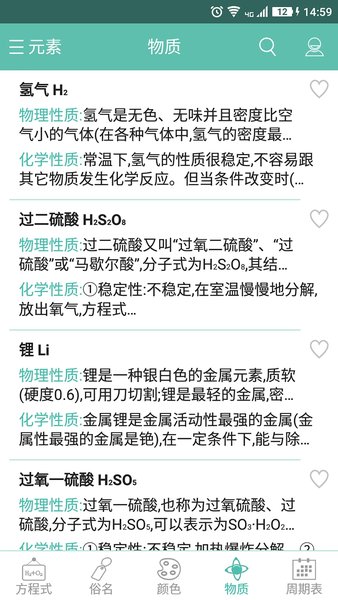
相關版本
多平臺下載
猜您喜歡換一換
查看所有0條評論>網友評論
 chemy化學app
chemy化學app 
 金十數據手機版147.7 MB新聞
金十數據手機版147.7 MB新聞
 ASCC Show官網版45.9 MB新聞
ASCC Show官網版45.9 MB新聞
 上海有色金屬網手機app171.6 MB新聞
上海有色金屬網手機app171.6 MB新聞
 龍游通官方版163.8 MB新聞
龍游通官方版163.8 MB新聞
 掃黃打非app最新版本64.57 MB新聞
掃黃打非app最新版本64.57 MB新聞
 合浦融媒免費版181.2 MB新聞
合浦融媒免費版181.2 MB新聞
 懂球帝官方正版139.3 MB新聞
懂球帝官方正版139.3 MB新聞
 趣頭條極速版最新版54.6 MB新聞
趣頭條極速版最新版54.6 MB新聞
 金十數據手機版147.7 MB新聞
金十數據手機版147.7 MB新聞
 ONE·一個手機版19.76 MB新聞
ONE·一個手機版19.76 MB新聞
 閃電搜索軟件87.7 MB新聞
閃電搜索軟件87.7 MB新聞
 龍游通官方版163.8 MB新聞
龍游通官方版163.8 MB新聞
 網易app
網易app 今日頭條
今日頭條 自媒體平臺
自媒體平臺 新浪app
新浪app 融媒體app
融媒體app 雜志軟件
雜志軟件